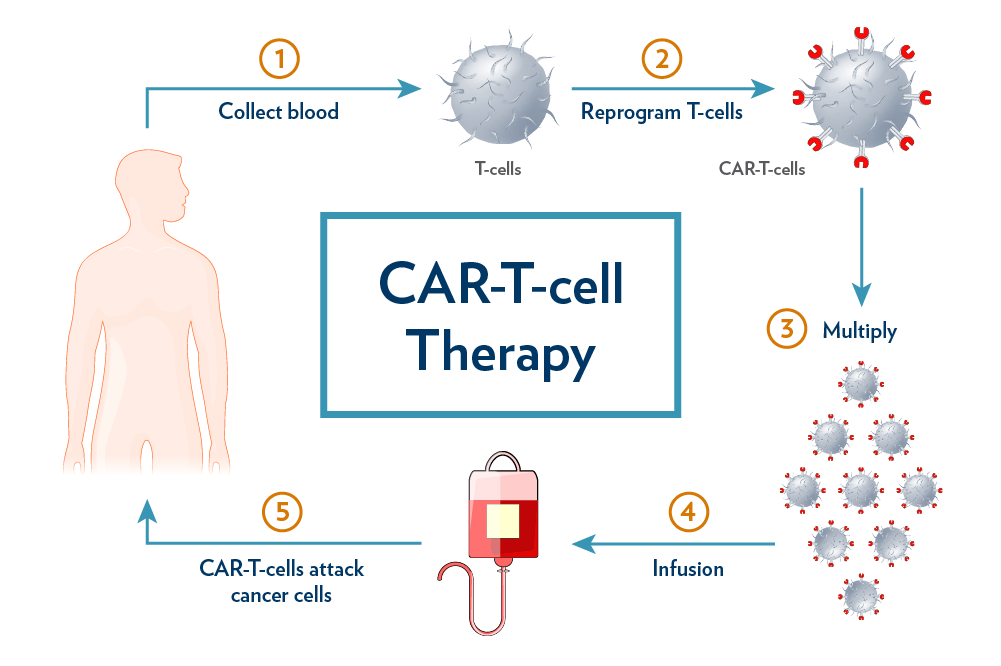
FDA سند راهنمای نهایی را با عنوان ملاحظات برای توسعه محصولات سلول T گیرنده آنتی ژن کایمریک (CAR) در ژانویه صادر کرد. بر اساس اکثریت، سند راهنما زمانی که برای اولین بار به عنوان پیش نویس در مارس2022 منتشر شد،و نکات با شفافیت بیشتری در هر بخش، مطابق با بسیاری از نظرات ارسال شده،اضافه شد.
به طور کلی،سند راهنمای CAR T یک خلاصه عالی در سطح بالا از ملاحظات کلیدی برای توسعه دهندگان فراهم می کند. چند زمینه شفافیت برای ملاحظات خاص اتولوگ یا آلوژنیک ارائه شده است.
توصیه ها و مثال های خاص تر برای انتخاب گسترده تر در درمان های مبتنی بر سلولT ، درمان های غیر مبتنی بر سلولT ، و نشانه های غیر سرطانی، در این سند مورد توجه قرار نگرفته و نشان دهنده شکاف ها در دستورالعمل های فعلی این صنعت است.
مقدمه و پیشینه
این سند با توصیه هایی برای حمایت از توسعه دهندگان در طراحی و توسعه محصولات سلول T CAR، با تاکید بر نشانه های سرطان شناسی ساختار یافته است. علی رغم درخواست ها یا نظرات چندین گروه هیچ تغییری برای گنجاندن توصیه هایی برای نشانه های غیر سرطان شناسی انجام نشد و شفاف سازی دامنه، تغییر خاصی بود که در سند نهایی ایجاد شد.
راهنمایی نهایی با تأکید بر محصولات سلول های CAR T تولید شده در خارج از بدن،همانطور که در نظرات ارائه شده توسط اتحاد پزشکی احیاکننده (ARM) پیشنهاد شده است،توضیح داده شده است.
ملاحظات عمومی برای طراحی و توسعه سلول های CAR T
نظرات،توجه ویژه را بر روی بخش فرعی مواد اولیه سلولی، در مورد برجسته بودن توصیه ها،برای بیمارانی که ممکن است درمان های قبلی سلول های CAR T را دریافت کرده اند،متمرکز کرد. پیش نویس دستورالعمل آزمایش، محصول لوکافرزیس را برای ارزیابی حضور سلول های CAR T قبلی و محصول نهایی دارویی برای تعیین سطح سلول های CAR T جدید و قبلی توصیه می کند.
توصیه های مربوط به واجد شرایط بودن بیمارانی که قبلاً درمان با سلول های CAR T دریافت کرده اند، از سند راهنمای نهایی،حذف شدند.
در پاسخ به نظرات ارسال شده به طور جمعی از طریق گروه کاری ARM و دیگران،توضیحات متعددی در ادامه این بخش اضافه شد:
ساختار CAR : انعطاف پذیری برای عملکرد دامنه سیگنالینگ اضافه شد.
وکتور: توضیحات جامع تری برای شناسایی یک (وکتور) به عنوان وسیله نقلیه ارائه دهنده مواد ژنتیکی گنجانده شد وضوح بیشتری برای گنجاندن نمونه هایی از تراریخته های غیر ضروری که نباید گنجانده شوند مانند ژنهای مقاومت آنتی بیوتیکی ارائه شد.
محصولات نهایی تازه یا منجمد شده: توجه به پایداری در حین استفاده به دلیل تأثیر بالقوه بر ماندگاری و کیفیت محصول به صراحت مورد توجه قرار گرفت. شامل کنترلهای خاصی برای اطمینان از کیفیت محصول در طول حمل و نقل به محل بالینی است مانند روشهایی برای توصیف(حمل و نقل، دریافت، ذخیره سازی و آماده سازی برای تزریق)
توصیه های CMC
این بخش شامل تغییرات زیادی در سند راهنمای نهایی از پیش نویس دستورالعمل است، اما پیام رسانی کلی تا حد زیادی بدون تغییر است.
ساخت و تست وکتور
وضوح اضافه شد تا نشان دهد که برای تحقیقات بالینی ایمنی و کیفیت وکتور باید به اندازه کافی مشخص شود علاوه بر این اشاره شد که وکتور باید طبق GMP برای”مطالعات فاز بعدی و برای صدور مجوز”ساخته شود. در اینجا،تعریف جامع تری برای وکتور استفاده کرده است، اما علیرغم نظرات مستقیم از چندین گروه هیچ وضوحی برای الزامات تولید، برای اجزای ویرایش ژن حیاتی مانند پلاسمیدها اضافه نشده است.
ساخت و آزمایش سلول های CAR T
کلیت تغییرات در این بخش تا حد زیادی جزئی باقی می ماند و به نظر می رسد که توسط نظرات ارسال شده که نشان دهنده عدم وضوح است، ایجاد شده است.نکات قابل توجه عبارتند از:
- توضیح اینکه روشهای مناسب برای صلاحیت مواد کمکی باید ارزیابی شوند.
- توضیح اینکه تولید باید تحت یک فرآیند آسپتیک (ضدعفونی شده) واجد شرایط انجام شود.
- علاوه بر این باید مطالعاتی برای استفاده از زمان نگهداری و تجویز برای محصولات ،تازه یا زمان بین ذوب و تجویز برای محصولات منجمد شده انجام شود.
پیش نویس راهنمای توصیه شده مطالعات پایداری سلول های CAR T ، برای ارزیابی دقیق تر از ماندگاری محصول است.
تغییرات بسیار کمی در طول بخش تست تحلیلی ایجاد شد.
توصیه های غیر بالینی
هیچ تغییر عمده ای در محتوای توصیههای غیر بالینی وجود نداشت. قابل ذکر است، در این بخش و در سراسر دستورالعمل عبارت پیش بالینی” با عبارت “غیر بالینی” جایگزین شد که با قانون اصلاح مواد غذایی و دارویی سال 2022 (FDORA) مطابقت دارد.
توصیه های بالینی
در راهنمایی نهایی، FDA توضیحاتی ارائه کرد که به طور کلی انعطاف پذیری بیشتری را برای حامیان مالی فراهم می کرد. علاوه بر این، راهنمایی نهایی بر اهمیت یک برنامه پیگیری بلندمدت با بودجه، تاکید کرد.
طرح درمان
در پیش نویس دستور العمل، FDA در ابتدا توصیه میکرد که دوز سلول های CAR T را بر اساس وزن بدن/مساحت سطح بدن (BSA) به جای استفاده از دوز ثابت محاسبه کنید. مرکز ایمونوتراپیهای سلولی از FDA درخواست کرد که این توصیه را در نظرات خود بر اساس تجربه خود در استفاده از دوز بر اساس وزن در آزمایشات تومور جامد بزرگسالان تجدید نظر .کند FDA این درخواست را پذیرفت.
ارزیابی و نظارت ایمنی
FDA توصیه خود را برای نظارت بر سطوح سیتوکین در بیماران در ابتدا و در مقاطع زمانی از پیش تعیین شده حذف کرد نظر دهندگان اشاره کردند که نتایج سطح سیتوکین خون ممکن است به موقع برای تصمیم گیری در مورد درمان در دسترس نباشد و سطح سیتوکین خون معمولاً برای هدایت الگوریتم های مدیریت سندرم آزادسازی سیتوکین (CRS) مورد استفاده قرار نمی گیرد.
منبع:cellandgene
دیدگاه خود را بنویسید